- مقدمه : ویتامین D نوعی سکواستروئید می باشد که دارای دو شکل شیمیایی مجزا (ویتامین D2 و D3) می باشد که از نظر بیولوژیکی دارای اثرات یکسان می باشند. ویتامین D2 یک ملکول 28 کربنی است که از ارگوسترول گیاهی مشتق می شود .درحالیکه ویتامین D3 یک ملکول 27 کربنی است و از کلسترول مشتق می گردد. وقتی ویتامین D وارد بدن انسان می شود ، در کبد هیدروکسیله شده و به شکل فعال آن تبدیل میشود.مشتق 25 هیدروکسیله ویتامین D ، شکل عمده ذخیره ویتامین D دربدن می باشد. لذا تعیین غلظت Vitamin D OH25 در سرم نشانگر اولیه سطح این ویتامین در بدن می باشد.
دانلود روش کار کیت
– اساس روش اندازه گیری کیت الایزای25-Hydroxy vitamin D موجود بر اساس سنجش ایمونولوژیکی رقابتی تهیه شده و از روش پوشش آنتی بادی استفاده شده است .
25-OH-Vitamin D موجود در نمونه ها برای اتصال به آنتی بادی منوکلونال ضد 25-OH-Vitamin D که برروی پلیت پوشش داده شد با 25-OH-Vitamin D-Biotin رقابت می کند. پس از زمان انکوباسیون، پلیت ها تخلیه و شستشو می شوند. سپس کونژوگه HRP-Streptavidin به چاهک ها اضافه می شود. پس از زمان انکوباسیون، چاهک ها تخلیه شده و شستشو داده می شوند. سپس به هر چاهک سوبسترای آنزیم اضافه می شود که فعالیت آنزیم بطور معکوس با غلظت 25-OH-Vitamin D در نمونه ها متناسب است. استانداردهای 25-OH-Vitamin D با غلظت مشخص، همراه با نمونه های مجهول آزمایش می شوند که بر اساس منحنی استاندارد جذب نور در مقابل غلظت25-OH-Vitamin D ، غلظت نمونه های مجهول بدست می آید.
3- اجزاء کیت
1– پلیت های پوشش داده شده : شامل 96 چاهک که با آنتی بادی ضد25-OH-Vitamin D پوشش داده شده اند.
2- استانداردها : 6 ویال 0/5 میلی لیتری از استاندارد با غلظت های 0 ، 4، 10 ،25 ،60 ، 120 بر اساس ng/ml که در سرم نرمال انسانی تهیه و از تیومرسال بعنوان نگهدارنده استفاده شده است.
3- Releasing Buffer : یک ویال 25ml
4- بیوتین غلیظ Biotin-25-OH-Vitamnin D : (51X) یک ویال 0.6ml
که برای تهیه Releasing Buffer آماده مصرف لازم است این محلول به نسبت یک به 50 با Releasing Buffer رقیق شود.
5- سرم کنترل : 2 ویال 0.5ml آماده مصرف .
6-کونژوگه آنزیمی (HRP-Streptavidine) : یک ویال ml 12 آماده مصرف.
7- محلول شستشو دهنده غلیظ (21X) : یک ویال 15ml محلول شستشو که برای تهیه محلول شستشوی آماده مصرف لازم است این محلول به نسبت 1 به 20 (1+20) با آب دیونیزه رقیق شود.
8- محلول سوبسترای A : یک ویال 7ml
9- محلول سوبسترای B : یک ویال 7ml
10- محلول متوقف کننده واکنش: یک ویال 12ml اسیدسولفوریک 1N
4- مواد و وسایل مورد نیاز که در کیت موجود نیست
1- سمپلر 25 ، 100 و 200 میکرولیتری دقیق
2 -آب دیونیزه
3- کاغذ جاذب رطوبت
5- نکات قابل توجه برای مصرف کنندگان
1- از تماس محلول متوقف کننده واکنش (H2SO4) 1 نرمال با پوست خودداری کنید. در صورت تماس، فورا با آب فراوان آنرا بشوئید.
2- از استفاده معرف های کیت پس از تاریخ انقضاء خودداری کنید و از مخلوط کردن یا استفاده از کیت ها با شماره بچ مختلف پرهیز نمائید.
3- درب ظروف را پس از استفاده ببندید و از تعویض درب ها جدا خودداری کنید.
4- محلول های محتوی مواد افزودنی یا نگهدارنده مثل سدیم آزاید نباید در واکنش آنزیمی وارد شوند.
5- کیت های باز نشده پس از تحویل باید در دمای 8-2 درجه سانتیگراد (یخچال) نگه داری شوند. میکروپلیت باید در کیسه دربسته به همراه ماده جاذب رطوبت نگهداری شود.
6- هر چند سرم های استفاده شده در ساخت کیت از نظر هپاتیت و ایدز تست شده اند ولی محلول های کیت را بعنوان مواد بالقوه آلوده (خطرناک ) محسوب کنید .
7 – کیت باید تا تاریخ انقضا استفاده شود (یکسال از زمان تولید). برای اطلاع از تاریخ انقضا به برچسب کیت مراجعه شود.
8- کیت های باز شده حداکثر به مدت 2 ماه پایدار خواهد ماند . ( اگر در شرایط توصیه شده بالا نگهداری شود)
9- توصیه می شود که بیشتر از 48 چاهک در هر مرحله کاری استفاده نشود. اگر پی پت به صورت دستی انجام می گیرد، پی پت کردن همه استانداردها، نمونه ها ، کنترل ها باید در 5 دقیقه تمام شود. برای پی پت کردن کل پلیت 96 تستی باید از پی پت اتوماتیک استفاده شود.
10- فرایند شستشو خیلی مهم است. شستشوی ناکافی باعث کاهش دقت و افزایش کاذب جذب می شود.
6 – تهیه و جمع آوری نمونه
1- آزمایش را باید بر روی نمونه های سرمی انجام داد . نمونه های شدیدا همولیزه و دارای چربی باید حذف شوند
2- نمونه ها را می توان برای 5 روز در دمای 2 تا 8 درجه سانتیگراد و برای زمان های طولانی تر (تا سی روز) در دمای 20- درجه سانتیگراد نگهداری نمود. لطفا از انجماد و ذوب مکرر نمونه ها خودداری نمائید .
7- آماده سازی معرف ها
1- برای تهیه Releasing Buffer آماده مصرف، یک حجم از کونژوگه بیوتینه غلیظ (51X) را با 50 حجم Releasing Buffer رقیق نموده و کاملا مخلوط نمایید. برای هر بار آزمایش باید این محلول تازه تهیه شود (در جدول صفحه بعد روش رقیق سازی و تهیه این بافر ارائه شده است).
2- برای تهیه محلول شستشوی آماده مصرف، یک حجم از محلول شستشو غلیظ (21X) را با 20 حجم آب دیونیزه رقیق نمائید.
راهنمای رقیق سازی و تهیه Releasing BUFFER آماده مصرف
|
ردیف |
تعداد استریپ |
حجم Releasing Buffer (µL) |
حجم بیوتینه غلیظ (µL) |
|
1 |
دو |
4000 |
80 |
|
2 |
چهار |
8000 |
160 |
|
3 |
شش |
12000 |
240 |
8- روش انجام آزمایش
1- تعداد چاهک های کوت شده برای استانداردها و سرم کنترل و نمونه های بیمار را انتخاب کنید و مابقی چاهک ها را همراه رطوبت گیر درون کیسه پلاستیکی قرار داده و درب آنرا ببندید.
2– 50 میکرولیتر از استانداردها، سرم کنترل و نمونه های بیمار را به داخل هر چاهک بریزید.
3- 200 میکرولیتراز Releasing Buffer آماده مصرف(50+1حجم بیوتین غلیظ) را به تمام چاهک ها اضافه کنید(طبق دستور العمل جدول راهنمای رقیق سازی).
4- پلیت را حداقل بمدت یک دقیقه به آرامی تکان دهید تا محتویات چاهک ها خوب مخلوط شوند (در این مرحله مخلوط کردن کامل بسیار مهم است). سپس پلیت را بمدت 60 دقیقه در درجه حرارت اتاق (22 تا 28 درجه سانتیگراد) و تاریکی انکوبه کنید.
5- محتویات چاهک ها را خالی کرده و چاهک ها را 3 بار با 300 میکرولیتر محلول شستشوی آماده مصرف بشوئید. (1+20 حجم آب دیونیزه)
برای شستشوی چاهک ها، ابتدا 300 میکرولیتر محلول شستشو را داخل چاهک ها بریزید، سپس چاهک ها را وارونه کرده و همراه با تکان دادن خالی کنید و در انتهای شستشو، با ضربات ملایم بر روی کاغذ جاذب تمامی مایع موجود در چاهک ها را تخلیه نمائید.
6– 100 میکرولیتر از کونژوگه آنزیمی آماده مصرف به تمامی چاهک ها اضافه کنید. و چاهک ها را بمدت 30 دقیقه در درجه اتاق (22 تا 28 درجه سانتیگراد) و تاریکی انکوبه کنید.
7- محتویات چاهک ها را خالی کرده و چاهک ها را 3 بار با 300 میکرولیتر محلول شستشوی آماده مصرف ( 1 + 20 حجم آب دیونیزه ) بشوئید . برای شستشوی چاهک ها، ابتدا 300 میکرولیتر محلول شستشو را داخل چاهک ها بریزید، سپس چاهک ها را وارونه کرده و خالی کنید و در انتهای شستشو ، با ضربات ملایم بر روی کاغذ جاذب تمامی مایع موجود در چاهک ها را تخلیه نمائید.
8– 100 میکرولیتر از سوبسترایی که آماده کرده اید (50 لاندا سوبسترای A و50 لاندا سوبسترای B ) به تمامی چاهک ها اضافه کنید و آنها را بمدت 15 دقیقه در دمای اتاق و تاریکی انکوبه نمائید .
9- 100 میکرولیتر از محلول متوقف کننده واکنش به همه چاهک ها اضافه کنید .
10- جذب نوری (OD) هر چاهک را در طول موج 450 نانومتر با دستگاه الایزا ریدر خوانش نمائید (در صورت امکان از طول 630 نانومتر بعنوان فیلتر مرجع استفاده کنید). سنجش جذب نوری باید حداکثر تا 10 دقیقه پس از اتمام آزمایش انجام شود.
9- محاسبه نتایج
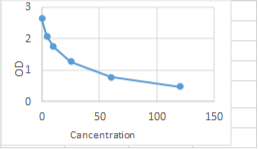
1- با استفاده از میانگین جذب نوری استانداردها (محور Y) و غلظت مشخص آنها (محور X) برروی کاغذ میلی متری، منحنی استانداردی رسم کنید.
2- میانگین جذب نوری برای هر نمونه را بدست آورده و روی محور Y جای آنرا پیدا کنید. سپس نقطه مذکور را توسط خطی به منحنی وصل کنید. از نقطه بدست آمده خطی عمود بر محور X وارد کنید تا نقطه تلاقی که نشان دهنده غلظت نمونه است، بدست آید.
3- با استفاده از کامپیوتر این محاسبات ساده خواهد شد.
10- راهنمای محاسبه
مقادیر جذب نوری ارائه شده در جدول ذیل تنها بعنوان راهنمایی آورده شده است و هر آزمایشگاهی باید برای هر بار آزمایش یک منحنی استاندارد جدید بدست آورد
|
OD |
Vit D Con. (ng/ml) |
No. |
|
2.64 |
0 |
1 |
|
2.08 |
4 |
2 |
|
1.75 |
10 |
3 |
|
1.27 |
25 |
4 |
|
0.78 |
60 |
5 |
|
0.48 |
120 |
6 |
منحنی استاندارد ویتامین D به روش Point To Point
|
غلظت ویتامین D (ng/ml) |
سطح دریافت |
|
کمتر از 20 |
کمبود |
|
29 – 20 |
ناکافی |
|
70 – 30 |
کافی |
|
100-70 |
بیش از حد نرمال |
|
بیشتر از 100 |
سمیت بالقوه |
11- مقادیر طبیعی
بدلیل اختلافات سنی، نژادی و رژیم تغذیه، نمی توان برای تمام جمعیت ها محدوده مرجع تعیین کرد. بنابراین هر آزمایشگاه باید محدوده مرجع خود را گزارش نماید. مقادیر طبیعی در سرم افراد نرمال که توسط آزمایشات مکرر با این روش بدست آمده است به قرار زیر می باشد
برای تبدیل به واحد به شرح ذیل می توان عمل کرد
ng /ml × 2.5 = nmol/l
12- پارامترهای کنترل کیفی :
1 – Intra Assay: دقت داخلی با ارزیابی تکرار پذیری حاصل از سه نمونه سرم با غلظت های متفاوت در یک نوبت کاری و 6 1 بار تکرار بررسی شد. معیار قابل پذیرش CV≤ %10 می باشد .
|
3 |
2 |
1 |
Serum Sample |
|
16 |
16 |
16 |
No . Of Repeats |
|
82.70 |
44.20 |
15.63 |
Mean Vit . D (ng/ml) |
|
4.01 |
3.12 |
1.17 |
SD (ng/ml) |
|
4.84 |
7.05 |
7.48 |
CV (%) |
2– Inter Assay : دقت بین تستی با ارزیابی تجدید پإیری حاصل از سه نمونه با غلظت های متفاوت در سه نوبت کاری و 8 بار تکرار برای هر نمونه در هر نوبت کاری انجام شد. معیار قابل پذیرش CV≤ %10 می باشد.
|
3 |
2 |
1 |
Serum Sample |
|
24 |
24 |
24 |
No . Of Repeats |
|
91.5 |
53.80 |
10.60 |
Mean Vit D (ng/ml) |
|
4.8 |
4 |
0.89 |
SD (ng/ml) |
|
5.24 |
7.43 |
8.39 |
CV (%) |
Recovery- 3: دو نمونه سرم به نسبت مساوی با یکدیگر ترکیب و بعنوان یک نمونه مقدار آن اندازه گیری شد .که معیا ر پذیرش تغییر کمتر از 10 درصد می باشد .
|
Rec (%) |
Obs ng/ml |
Exp
ng/ml |
Added
ng/ml |
Sample
ng/ml |
NO |
|
95 |
20.3 |
21.3 |
29.2 |
13.5 |
1 |
|
103 |
54.5 |
53.1 |
71.3 |
34.9 |
2 |
| 102 | 83.2 | 80.9 | 116.6 | 45.2 |
3 |
4 – Linearity : در این تست مقدار Vit .D در رقت های مختلف نمونه سرم جهت خطی بودن کیت اندازه گیری شد .
|
1/16 |
1/8 | 1/4 | 1/2
Bias |
Sample |
NO |
| 0.82 | 0.82 | 2.06 | -1.44 | 96.83 |
1 |
5Cross Reactivity- : در این تست غلظت های مختلفی از مواد مداخله گر به سرم اضافه شد و واکنش متقاطع با اندازه گیری نسبت بین مقدار ماده مداخله گر به مقدار Vit.D مورد نیاز برای ایجاد همان مقدار جذب سنجش شد .
|
نوع ماده |
درصد تداخل |
|
25-OH-VitaminD3 |
100 |
|
25-OH-Vitamin D2 |
97 |
|
Vitamin D3 |
0.04 ˂ |
| Vitamin D2 |
0.05 ˂ |
Sensitivity – 6 : حساسیت کیت بر اساس حد تشخیص (LOD) Limit Of Detection و حد تشخیص بلانک (LOB) Limit Of Blank با استفاده از فرمول زیر محاسبه شد که برابر1.2 ng/ml تعیین گردید .
LOB = Mean blank – 1.645 ( SD blank )
LOB = 2. 44 – 1. 645 ( 0 . 0 21 ) = 2. 406
LOD = LOB – 1.645 ( SD ST.4 )
LOD = 2. 406 – 1. 645 ( 0 . 0 6 ) =2. 307
با توجه به جوابهای فوق و میانگین St 4= 2. 13 و انتقال داده ها روی کاغذ شطرنجی و حاصل نقطه LOD با مقدار 2. 307 غلظت 1. 2 ng / ml بدست می آید.
References:
1) McCollum jr EV,Simmonds N,Becker JE, ShipleyPG.Studies one xperimental tickets. XXI.An experimental demonstration of the existence of a vitamin which promotes calcium.J Biol Chem1922:53:293-6
2) McCollum EV,Davies M,The necessity of certain lipids in the diet during growth.J Biol Chem 1913:15:167-72.
3) Zitteman A.Vitamin D in Preventative medicine: are we ignoring the evidence?
Br J Nutr 2003:89:552-72
4) McKenna MJ Freaney R.Secondary hyperparathyroidism in the elderly :means to defining hypovitaminosis D.Osteoporos Int. 1998:8:S3-6.
5) Heancy RP,Dowell MS, Hale CA,Bendich A Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr 2003:22:142-6.
6) Ritz E.Boland R.Kreusser W.Effects of vitamin D and parathyroid hormone on muscle:Potential role uremic myopathy. Am clin Nutr 1980:33:1522-9
7) curry OB,Bastein JF.Francis MJO. Smith R. Calcium uptake by sarcoplasmic reticulum of muscle from vitamin D deficient rabbits. Nature 1983:249:83-4.
8) Guyton KZ.Kensler TW,Posner GH. Cancer chemoprevention using natural vitamin D and synthetic analogs. Annu Rev Pharmancol Toxicol 2001:41:421-42











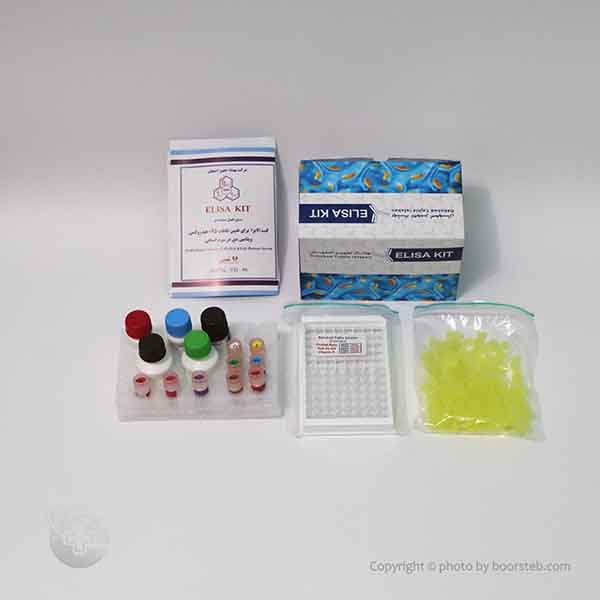
کیت ویتامین D برند BTi
Vitamin D kit brand BTiدیگران را با نوشتن نظرات خود، برای انتخاب این محصول راهنمایی کنید.
لطفا پیش از ارسال نظر، خلاصه قوانین زیر را مطالعه کنید: فارسی بنویسید و از کیبورد فارسی استفاده کنید. بهتر است از فضای خالی (Space) بیشازحدِ معمول، شکلک یا ایموجی استفاده نکنید و از کشیدن حروف یا کلمات با صفحهکلید بپرهیزید. نظرات خود را براساس تجربه و استفادهی عملی و با دقت به نکات فنی ارسال کنید؛ بدون تعصب به محصول خاص، مزایا و معایب را بازگو کنید و بهتر است از ارسال نظرات چندکلمهای خودداری کنید. بهتر است در نظرات خود از تمرکز روی عناصر متغیر مثل قیمت، پرهیز کنید. به کاربران و سایر اشخاص احترام بگذارید. پیامهایی که شامل محتوای توهینآمیز و کلمات نامناسب باشند، حذف میشوند. از ارسال لینکهای سایتهای دیگر و ارایهی اطلاعات شخصی خودتان مثل شماره تماس، ایمیل و آیدی شبکههای اجتماعی پرهیز کنید. با توجه به ساختار بخش نظرات، از پرسیدن سوال یا درخواست راهنمایی در این بخش خودداری کرده و سوالات خود را در بخش «پرسش و پاسخ» مطرح کنید. هرگونه نقد و نظر در خصوص سایت بورس طب، محصولات و ارسال کالا را با ایمیل info@boorsteb.com یا با شمارهی 91690575 - 021 در میان بگذارید و از نوشتن آنها در بخش نظرات خودداری کنید.